자신을 인식하는 물질, 존재와 의식... 자연철학적 접근
열역학-자유에너지 본문
열역학을 처음에 접하면, 여러 변수들이 어지럽게 나열되고, 에너지의 종류가 아래 그림과 같이 4가지나 정의되는 등 혼동이 오는 경우가 있다. 이는 상태 변수들 P, V, S, T가 모두 독립적이지 않고, 이 중 보통은 2개, 만약 입자의 수를 포함하면 3개의 변수들만이 독립적인 변수이기 때문이다. 따라서, 어떤 변수를 고정하느냐에 따라서 같은 방정식의 다양한 표현이 가능하다. 이번에는 열역학에서 말하는 여러 에너지들,에 대해서 간단히 정리해 보자.

1. 엔탈피
이제 아래와 같이 변수 S와 P로 주어지는 엔탈피 (entalphy) H를 정의할 수 있다. 엔탈피는 P가 일정한 경우의 내부에너지를 구하거나, 유체역학에서 많이 사용된다고 한다.
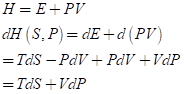
만약 dP=0, 즉 압력이 일정하다면 dH=TdS=dQ, 즉 외부에서 가해진 열량이 엔탈피의 증가로 나타난다. 보통 화학 반응은 압력은 일정한 (예를 들어 대기압의 방안, 압력이 일정한 액체) 상태에서 부피의 변화로 나타나기에 엔탈피는 화학 분야에서 반응열을 얘기할 때 많이 나온다. 예를 들면

에서 엔탈피의 변화량 136.3 KJ/mol이 줄어들고, 이것이 반응 열로 방출된다.

2. 헬름홀츠 자유에너지
이제 상태변수를 T와 V에 대해서 정의하면 아래와 같은 Helmholtz free energy F를 정의할 수 있다. 이것은 실제로 Energy가 U(S,V)를 F(V,T)로 변수 변환하는 Legendre transform에 해당한다. 물리학 분야에서 free energy라고 하면 보통은 F를 얘기한다.

물리학자들이 보통 자유에너지라고 얘기하면 Helmholtz free energy를 지칭하는 경우가 많다. F는 모두 측정이 가능한 V, T, N이라는 변수들의 함수이기에 편리한 경우가 많다. 만약 온도가 일정한 (isothermal) 상태라면 dF=-PdV=-dW가 되어, F의 변화량은 외부에 일의 형태로 나타난다. 따라서 자유롭게 일을 할 수 있는 에너지라는 의미에서 free energy라는 용어가 붙는다. 온도가 일정한 상태에서 고립계는 F가 최소화하는 지점에서 평형 상태에 이른다.
F로부터 다른 상태 변수들의 값은 아래와 같이 구할 수 있다.

3. 깁스의 자유에너지
마지막으로 상태변수 T와 P에 대해서 다음과 같은 Gibbs free energy G를 정의할 수 있다.

깁스 자유에너지는 헬름홀츠 자유에너지의 E-TS를 H-TS로 대체한 것이다. G는 압력이 일정한 상황에서의 화학 반응을 얘기할 때에 편리하기에 화학자들이 자유에너지를 얘기하면 Gibbs free energy인 경우가 많다. 압력과 온도가 일정하다면 화학 반응은 G가 가장 낮은 상태에서 평형에 이른다. 만약 P와 T가 가 일정하다면 dG=dE-TdS+PdV=dQ-TdS이고 Clausius 이론에 따라 dS>dQ/T이므로 dG<0 인 방향으로 자발적 반응이 일어나기에 화학 분야에서 많이 얘기하는 에너지이다.
'양자이론' 카테고리의 다른 글
| 통계역학 - 보존과 페르미온 통계 (0) | 2021.02.18 |
|---|---|
| 와인과 아레니우스 방정식 (0) | 2021.02.17 |
| 열역학 법칙들 (0) | 2021.02.15 |
| 통계역학-Ensemble에 대해 (0) | 2021.02.11 |
| 볼츠만 분포 (0) | 2021.02.10 |




