자신을 인식하는 물질, 존재와 의식... 자연철학적 접근
와인과 아레니우스 방정식 본문
와인을 좋아하는 사람들은 보통 와인 냉장고를 가지고 있다. 레드 와인의 경우 12~15도 정도, 화이트 와인은 7~10도 정도로 맞춰추는 와인 전용 냉장고이다. 냉각방식에 따라 컴프레서식 혹은 펠티어 방식이 있는데, 후자는 요즘 한창 얘기되는 미래의 쌀, 반도체 동작 원리에 따라, 열을 보담은 자유 전자 (free electron)를 이동시켜 냉각시키는 방식이다.

Natural wine을 제외한 거의 모든 와인들은, 와인 외에도 수많은 화합물들을 첨가하여 제조된다. 떼루아가 비슷한 토양에서 생성되는 와인들의 품질은, 와인 자체의 관리 외에도 과학적인 양조 공정에 의해서 좌우된다. 물론, 궁극적으로는 유대자본에 의한 마케팅이 가장 중요하며, 그러한 마케팅에 의한 이데올로기가 와인의 가격을 지배한다. 전세계 고가와인 중 다수가 로스차일드 가문의 작품이다.
화학에서 아레니우스(Arrehenius) 식이 있다. 아레니우스(1859-1927)는 스웨덴의 웁살라 대학에서 물리학을 전공한 후 화학 분야에 이를 응용하여 물리화학이라는 분야를 개척한다. 그는 소금이 물에 녹으면 전하를 띤 이온 상태로 된다는 이론인 전리 이론(electrolytic dissociation theory)로 박사학위를 받는다. 그 당시만 하더라도 분자가 이온 상태로 분해 된다는 개념이 전혀 없었기에 논문에 불합격될 뻔하였다 (그랬으면 아마 1903년 노벨화학상은 다른 과학자가 수상했겠지만..). 그리고 그는 산성과 염기성 물질의 본질, 즉 산성 물질은 용해되어 H+, 수소이온을 생성하고 염기는 OH-, 수산기 이온을 생성한다는 것을 알아낸다.

우리는 흔히 산화 반응을 산소와 결합하는 것, 즉 타거나 녹이 슬거나 하는 것으로 알고 있지만 산화(oxidation)는 수소나 전자를 잃어버리는 것을 환원(reduction)은 반대로 수소 혹은 전자를 얻는 것을 말한다. 화학 문제중 1) Na + Cl=NaCl 과 2) NaCl à Na+ + Cl- 의 반응중 산화 환원 반응을 묻는 질문이 있다. 1)번은 맞지만 2)번은 아니다. 1)번과정에서 Na는 산화수가 0에서 1로 증가하여 산화되었고, Cl은 산화수가 0에서 -1로 감소하여 환원된다.

와인을 높은 온도에 보관하면 반응 속도가 빨라져서 빨리 숙성하고 낮은 온도에 보관하면 반대로 느려져서 숙성되지 않은 채 오래 보관할 수 있다. (사실 굳이 와인 냉장고가 없더라도 그냥 냉장고에 보관하거나 아주 높은 온도만 아니라면 그냥 상온에 두어도 사실 큰 지장은 없다.) 온도가 높을수록 화학 반응 속도가 증가한다. 이것을 정량적으로 말하는 식이 Arrehenius equation이다.
대부분의 화학 반응은 아래와 같은 그래프로 진행된다. 현재 상태는 local minimum이기 때문에 그 상태에 어느 정도 안정화되어 머물 수 있다. 그러나, 그 아래쪽에 또 다른 local minimum 점이 있고, 그 점의 Gibbs free energy가 현재 상태보다 더 낮다면 자발적으로 화학 반응이 진행된다. 물론, 반대 방향으로도 반응이 이루어지겠지만, 그것보다 더 많은 입자들이 오른쪽으로 이동하기에 궁극적으로는 더 낮은 상태로 이동한다.
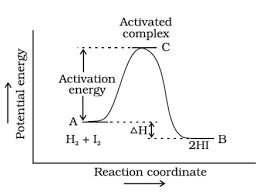
왼쪽에서 오른쪽으로 벽을 넘어가려면 그 포텐셜 에너지 장벽을 넘을 수 있을 만큼의 운동 에너지(활성화 에너지, activation energy라고 한다)가 필요하다. 와인 안의 온도는 그 안에 있는 입자들의 평균 운동에너지를 말한다. 평형 상태에서 와인이나 방안의 공기들이 가만히 있는 것 같지만, 실제로는 아보르드로의 수에서 보듯이 엄청난 분자들이 끊임없이 에너지를 주고 받고 있다.

방안의 온도가 30도라고 할 때, 기체 분자들의 평균 운동 에너지가 30이지, 모든 분자의 운동에너지가 30은 아니다. 그것들의 운동 에너지는 아래 그림과 같은 Maxwell-Boltzmann distribution을 한다. 온도가 높아질 수록 평균 에너지도, 그리고 분산도 커지기에 활성화 에너지 장벽을 넘어서 옆에 있는 다른 상태로 이동하는 것이 와인 숙성의 과정이다.

그러하나 화학적인 반응속도가 정량적으로는 아래와 같은 식으로 주어짐을 1889년 Arrenenius가 발견한다. K가 반응속도이고, A는 아레니우스 상수, Ea는 활성화 에너지, R 은 기체 상수, T가 온도이다. 대략 10도 증가하면 반응속도가 2배 정도 빨라진다고 한다. 즉, 상온에 와인을 보관하면 와인 쎌러에 보관할 때보다는 좀 더 일찍 시음을 해야 한다는 상식적인 얘기이다.


누군가에게는 무미건조한 재미없는 과학 얘기일 수도 있지만, 때로는 Gibbs의 자유에너지, 아레니우스 방정식을 떠 올리면서 와인 맛을 음미하셔도 좋을 것이다. 혹은 와인 한잔에 들어간 수많은 화합물들을 결합하게 하는 이온 결합, 그 저변에 깔린 맥스웰의 파동 방정식을 떠올리거나, 궁극적으로 존재들을 있게 반든 빅뱅과 초신성 불꽃파티를 떠올리셔도 재미있을 것이다.

'양자이론' 카테고리의 다른 글
| 통계역학, 브라운 운동과 확산 (0) | 2021.02.19 |
|---|---|
| 통계역학 - 보존과 페르미온 통계 (0) | 2021.02.18 |
| 열역학-자유에너지 (0) | 2021.02.16 |
| 열역학 법칙들 (0) | 2021.02.15 |
| 통계역학-Ensemble에 대해 (0) | 2021.02.11 |




